單細胞功能蛋白質組學微流體研究進展(下)
3.用于基于靶向的單細胞蛋白質組學分析的微流體系統
在靶向蛋白質組學技術中,蛋白質是通過使用帶有傳感標簽(如共軛熒光團、同位素標簽或量子點)的親和探針進行分析的,這些探針會發射或轉導信號。為了實現高靈敏度并促進單細胞水平的靶向蛋白質組織學鑒定,微流體的使用越來越多,主要是因為它們提供了標記過程中更高的有效濃度、可控的細胞操作、大大減少的試劑消耗以及提高多路復用性和吞吐量的設計靈活性等優點。在下文中,我們回顧了微流體系統支持的基于靶向的SCP方法,特別關注了它們在過去5年的發展,因為它們的早期發展在之前的綜述中已經討論過。
3.1基于細胞計量學的單細胞方法
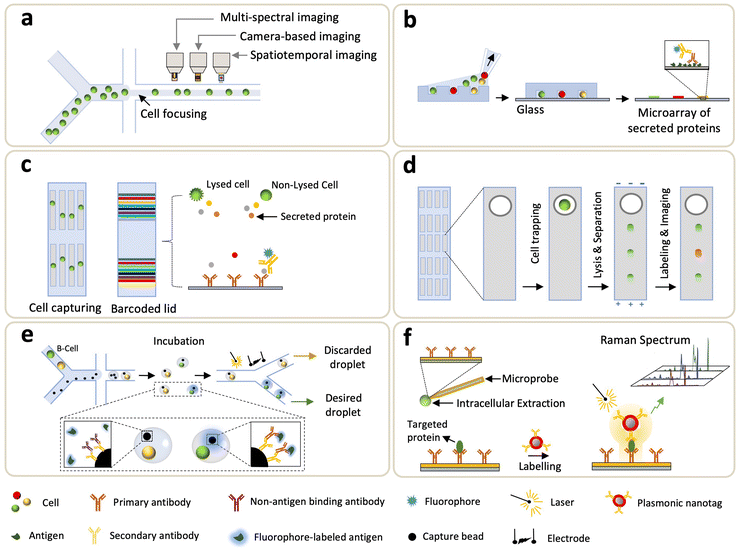
流式細胞術(FCM)是一種標準的分析技術,通過量化單個細胞的熒光發射和散射光,每秒可以計數和分析數千個細胞。使用FCM和熒光抗體來分析細胞中的蛋白質一直是生物科學的主流和廣泛應用。然而,FCM的細胞內空間信息有限,通常需要數十到數百μL的樣本量。當將流式細胞儀縮小到微流體尺寸時,多參數測量的帶寬會受到損害,例如,在高通量設置(>2000個細胞/秒)下表征細胞形態是一項挑戰。為了解決這個問題,成像流式細胞術(IFC)結合了高通量FCM和高分辨率成像顯微鏡的優勢,實現了細胞信息豐富的檢測(圖3a)。此外,IFC與微流體的集成允許簡單的光學實現和對細胞操作的精細控制。請注意,在大多數IFC微系統中,流體通量和光學檢測之間的權衡為在高通量下獲得體面的空間分辨率帶來了挑戰。為了解決這個問題,Holzner等人引入了使用多色熒光和亮場分析的多參數IFC,該方法能夠高分辨率和高通量地提取細胞形態特征,如準確的細胞大小和檢測人類細胞中的細胞質蛋白。該方法將頻閃照明(即一種為高速運動的物體生成無模糊圖像的技術)與彈性慣性3D細胞聚焦相結合,分別有效地控制流速和細胞定位,從而實現每秒104個細胞的采集率。
3.2微蝕刻法
微重力法利用亞納升孔捕獲細胞,細胞分泌的蛋白質被預處理的載玻片捕獲,載玻片上涂有親和探針(抗體或抗原)。Love等人開創了微重力生物芯片,其中微孔是通過沉積細胞懸浮液制備的,使細胞在去除多余的未被追蹤的細胞之前沉淀下來(圖3b)。然后將刻有抗體或抗原的載玻片貼在封閉的單細胞上,并通過熒光免疫測定法檢測分泌的蛋白質。Schubert等人開發了一種單分子陣列(SiMoA)平臺,該平臺能夠對單個細胞中的少量蛋白質進行計數。SiMoA表明,前列腺特異性抗原的表達在前列腺癌癥細胞中不同,并隨著基因漂移而變化。Jia等人探索了微雕刻方法來研究非人靈長類動物對蛋白質結合疫苗的縱向回憶反應。自首次亮相以來,不斷努力提高微雕刻方法的靈敏度,推動了從單細胞中檢測低豐度蛋白質。Li等人介紹了一種在蛋白質檢測中使用微孔平臺的信號放大方法,其中光學的軸向分辨率(即深度場)得到了提高,側壁和邊緣捕獲的熒光標簽也對信號做出了貢獻。與僅從平面發出熒光的傳統微重力方法相比,值得注意的是,邊緣增強微孔免疫測定將靈敏度提高了6倍。增強熒光的另一種方法是用半導體量子點代替有機染料,半導體量子點可用作熒光報告器來檢測單細胞分泌的蛋白質。總之,基于微孔的檢測比傳統的酶聯免疫吸附斑點(ELISpot)檢測具有更高的靈敏度。此外,這種方法還具有適用于下游分析的細胞分離等優點,并能夠通過多抗體雕刻的載玻片對單細胞分泌體進行動力學研究。
3.3微流控毛細管電泳和單細胞蛋白質印跡
毛細管電泳(CE)是一種分析方法,其特點是使用高電場進行高分離效率和靈敏的離子檢測。傳統的CE存在分離時間長、樣品消耗大和焦耳熱耗散慢的問題。另一方面,微流體CE(MCE)能夠解決這些局限性。MCE使用微通道在納升尺度上對生物分子進行電泳分離,分析時間需要數十秒,可用于分離和檢測從單細胞中提取的細胞內內容物。Huang等人開發了一種MCE,通過使用單分子熒光測量來檢測單細胞中的低拷貝數(LCN)蛋白質。請注意,這種方法的吞吐量相對較低,多路復用能力有限。為了提高通量,Mainz等人利用光可編程和細胞可滲透的報告器同時分析單個細胞的激酶活性。 Li等人還提出了一種基于多色熒光檢測的微流體裝置,用于單細胞操作,該裝置提供了有效的電泳分離,以實現多個小分子的同時檢測。總體而言,MCE利用短距離和相對較短的時間尺度,可以快速完成傳統CE中采取的所有步驟。
微流體中使用的另一種電泳方法是A.Herr小組開發的單細胞蛋白質印跡(scWB),其中特定蛋白質的鑒定和定量取決于它們通過與抗體探針結合的薄層凝膠基質的遷移(圖3d)。scWB將蛋白質印跡與開放式微孔陣列相結合,從而提高了檢測通量,并能夠可靠地處理約2000個神經干細胞。請注意,scWB的早期發展主要集中在處理大量輸入細胞,例如>1000個輸入細胞,因此無法處理質量有限的輸入細胞。為了解決這個問題,Sinkala等人將稀有細胞工作流程與scWB相結合,以分析單個循環腫瘤細胞(CTC)的蛋白質表達(復雜性=8)。具體來說,從患者血液中收集的細胞根據大小和變形性進行選擇,對大有核細胞進行染色和鑒定,然后轉移到微孔中。然后裂解這些細胞,將相關蛋白電泳注射到凝膠中,依次進行聚丙烯酰胺凝膠電泳(PAGE)、印跡和免疫印跡步驟。最近,差異分級被整合到電泳分離中:特別是,J.Vlassakis等人通過電泳和免疫測定讀數(SIFTER)引入了單細胞蛋白質相互作用分級,用于定量單細胞中的多聚體蛋白質復合物。在這項工作中,進行了雙向電泳,單體和解聚的蛋白質復合物被分級并固定在微孔周圍的凝膠區域,然后使用凝膠內免疫探針進行定量。除了高通量和負擔得起的多重性的優點外,scWB還由于電泳分離而提高了抗體的特異性。
3.4液滴微流體
液滴微流體技術能夠通過在納升體積的液滴中用熒光探針進行液滴包封來定量單個細胞釋放的分泌體,克服了微流體FCM無法檢測分泌蛋白的技術限制。液滴微流控技術也被用于分析細胞內蛋白質,其中一到三個細胞在液滴形成之前被電裂解。丁等人最近使用共流液滴微流技術將原代細胞(取自組織)與捕獲微珠和熒光標記抗原一起包封(圖3e)。在液滴孵育過程中,所需的細胞(如B細胞)分泌第一抗體,以介導熒光團標記的抗原與微珠之間的結合。隨后,通過熒光信號對被熒光抗原“標記”的所需液滴進行分選(圖3e)。液滴微流控方法可實現高通量分析;然而,檢測珠(在焦平面上)的排列使得對分泌的抗體進行定量變得具有挑戰性。為了解決這個問題,通過在液滴產生后將熱固性油的包封轉化為固體來證明液滴的固定化。另一方面,Eyer等人引入了一種基于液滴的微流體技術(DropMAP),從固定在2D陣列上的液滴中引出單細胞分析。DropMAP能夠實時測量以量化抗體分泌率、免疫親和性和相關動力學。關于DropMAP的工作原理,包封了兩個水相,其中一個包含細胞或校準抗體,另一個包含試劑(熒光標記和300 nm順磁性納米顆粒)。由于使用了納米顆粒,抗體的結合能力得到了提高。當施加磁場時,納米粒子(旨在捕獲分泌的免疫球蛋白)交聯,形成微米大小的聚集體。為了促進單個細胞在液滴內的封裝并提高多路復用性,Khajvand等人將液滴微流體與抗體條形碼集成在一起。使用約180 pL大小的腔室陣列來提高單細胞捕獲效率(超過80%,存活率>90%),這種方法大大提高了固定液滴中單細胞的片上捕獲、分離和長期培養。一般來說,基于液滴的微流體具有快速包封、提高靶濃度、減少樣品之間的交叉污染以及橋接基因型和表型的能力。
4.基于質譜的全球單細胞蛋白質組學分析技術
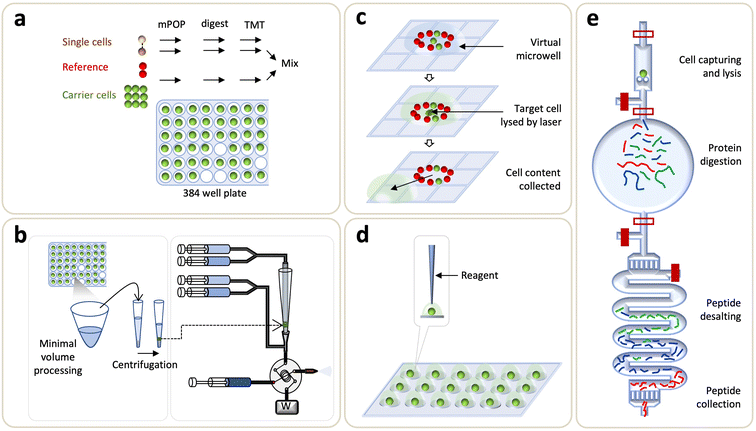
已經投入了大量努力來提高非靶向蛋白質組學工作流程的靈敏度,以達到具有良好覆蓋率、魯棒性和可靠性的單細胞分辨率。與基于親和力的方法相比,非靶向蛋白質組學分析允許對細胞蛋白質組進行全局映射,因此是面向發現的基礎研究和臨床研究的理想選擇。各種樣品制備方法、自動化儀器和LC-MS開發的最新進展使我們能夠使用無標記方法對單個細胞中的1000多種蛋白質進行定量。在下文中,我們將討論這些令人興奮的發展,其中包括簡要討論用于單細胞分析的LC-MS系統的演變、微流體支持的上游樣品處理以及隨后的數據采集和分析工作流程(圖4)。
5.SCP在生物學和臨床研究中的應用
5.1靶向單細胞蛋白測定的應用
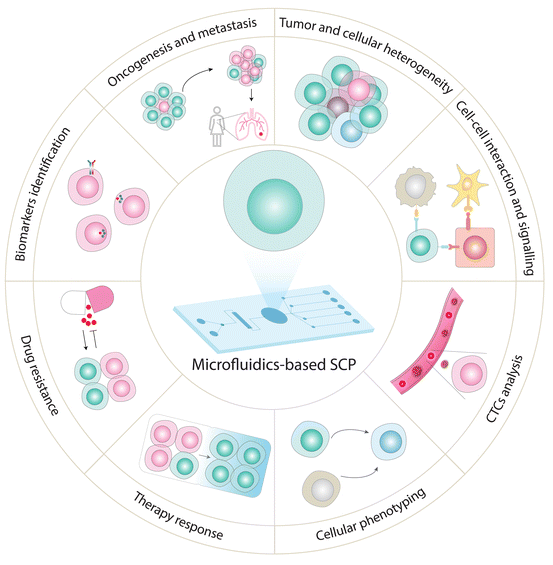
在本節中,我們介紹了各種基于微流體的靶向SCP檢測的生物學和臨床應用(圖5。由于微流體的獨特能力,它們對靶向SCP的實施促進了各種細胞生物學研究和臨床研究。例如,CyTOF是靶向SCP分析最廣泛使用的方法之一,提供了探索不同腦細胞中細胞表型的應用(基于信號標記物和細胞因子),免疫細胞分化,基于表面標記物的細胞異質性,和癌癥相關信號。CyTOF與細胞成像相結合,也被應用于探索組織內或細胞過程中單個細胞中蛋白質的亞細胞分布,促進了我們對免疫細胞功能的理解,以用于免疫治療應用。最近,Neuperger及其同事使用單細胞CyTOF進行了研究。基于13種蛋白質的表達模式的非小細胞肺癌細胞(NSCLC)系中的異質性和肺腺癌中的瘤內異質性。同樣,SCBC方法用于測量各種分泌、細胞質或膜蛋白的多重蛋白質豐度(由細胞產生的拷貝數決定)。通過仔細選擇和監測特定蛋白質標記的表達,SCBCs可以成為研究多種生物系統的工具。例如,異質性(細胞-細胞變異)可以通過監測參與不同信號通路的關鍵表型標記、轉錄因子和信號效應器的差異表達來解決。SCBC方法也被用于通過測量在近距離孵育的細胞釋放的分泌蛋白來探索細胞相互作用和通信。這種方法用于了解細胞在不同分離條件下如何相互作用,以及信號蛋白如何影響相鄰細胞。選擇性蛋白質標記的SCBC分析確實已成為研究功能異質性、信號通路、細胞間相互作用、細胞通訊、免疫細胞反應、和CTC分析的有前景的工具。Su等人應用SCBC芯片監測了18種蛋白質,包括表型標記、轉錄因子、單個黑色素瘤細胞中的信號效應器,以探索藥物誘導的信號動力學。這項研究揭示了黑色素瘤在BRAF抑制劑治療下的表型轉變,BRAF抑制劑激活了包括MEK/ERK和NF-κB在內的替代通路,進一步加速了腫瘤進展和耐藥性。表型。此外,Ullal及其同事使用SCBC探索了肺腺癌患者的腫瘤間和腫瘤內異質性,并仔細選擇了90個靶標記,以覆蓋臨床上使用的標志性途徑(如DNA損傷、細胞死亡)和診斷標記。
免責聲明:文章來源網絡 以傳播知識、有益學習和研究為宗旨。轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 液滴微流體
- 上一條沒有了
- 下一條單細胞功能蛋白質組學微流體研究進展(上)